Правила отбора проб
Отбор материала от живых животных. Кровь
Образцы цельной крови используют для гематологических исследований, клинической биохимии, токсикологии, непосредственного обнаружения бактерий и паразитов, ПЦР-диагностики, иммунологических тестов и для выделения культур бактерий и вирусов. В зависимости от диагностических целей, из отобранной цельной крови можно получить образцы клеток, плазмы при условии использования соответствующих антикоагулянтов. При выборе антикоагулянтов нужно учитывать требования лаборатории к отбору материала для разных методов диагностики, например, ПЦР, биохимических и токсикологических исследований, на которые могут негативно влиять некоторые антикоагулянты и консерванты. В частности, для исследования методом ПЦР пригодны образцы крови только с ЭДТА.
Образцы крови отбирают так чисто, как это возможно, путём венипункции. Кровь можно брать шприцем и иголкой или иглой с вакуумной пробиркой (нелегко для мелких вен, но очень удобно для крупных). В идеале, кожа в месте пункции вены должна быть протёрта ватным тампоном, смоченным 70%-м спиртовым раствором и высушена.
В зависимости от планируемого количества исследований, объем отбираемой крови составляет 1-3 мл. Для образцов, которые берут с антикоагулянтом, необходимо тщательное перемешивание путем аккуратного переворачивания пробирки сразу после взятия образца. Для реакции ПЦР предпочтительным антикоагулянтом является ЭДТА. Для получения образцов сыворотки кровь следует оставить при комнатной температуре (но избегая излишнего нагревания
или охлаждения) на 1-2 часа до образования плотного сгустка. Сгусток затем следует обвести по краю стерильной палочкой, сыворотку сливают или отбирают пипеткой. Пробирки помещают в холодильник при температуре 4 градуса. Цельную кровь нельзя замораживать, ее транспортируют только охлажденной. Замораживанию можно подвергать сыворотку и плазму, которые своевременно отделяют.
Результаты серологических исследований могут быть недостоверными по причине качества образца сыворотки. Бактериальная контаминация и остатки эритроцитов в сыворотке могут давать ложноположительные результаты в реакциях агглютинации. В свою очередь, бактериальная контаминация сыворотки в результате действия выделяемых бактериями ферментов - протеаз приводит к распаду белков, в т.ч. иммуноглобулинов, что может полностью
исказить результат серологических исследований. На серологические методы также отрицательно влияет гемолиз. Риски микробной контаминации и гемолиза очень важно учитывать при получении образца крови или сыворотки посмертно. Часто гемолиз происходит вследствие воздействия высоких температур или длительного времени контакта со сгустком до момента отделения сыворотки, а также при взятии крови иглой слишком мелкого диаметра или при
выпускании крови через иглу из шприца. При взятии и переливании крови следует действовать максимально аккуратно и осторожно для предотвращения повреждения эритроцитов во избежание гемолиза.
Кровь и сыворотку хранят и транспортируют в охлажденном состоянии, замораживать можно только сыворотку. Для транспортировки и хранения используют небьющиеся пластиковые пробирки; отобранную сыворотку удобно хранить и перевозить в пробирках типа эппендорф.
Отбор материала от живых животных. Фекалии
Образцы фекалий отбирают свежими сразу после дефекации или, предпочтительнее, непосредственно из прямой кишки; этот материал используется для бактериологических, паразитологических исследований. Следует отбирать по меньшей мере 10 г свежих фекалий. Для исследований методом ПЦР можно взять мазок со слизистой оболочки прямой кишки тампоном (лучше не использовать хлопковый). Тампон должен визуально быть покрыт фекальным материалом. Образцы, собранные тампоном от мелких животных (поросят), должны быть взяты без причинения вреда животному. Тампоны следует ранспортировать в пробирке.
Материал на тампоне для бактериологических исследований следует хранить во влажном состоянии, помещая в транспортную среду в соответствии с методом предполагаемого исследования. Это может быть стерильный физраствор или специальная культуральная среда. Фекалии для паразитологических исследований помещают в контейнер и отправляют в лабораторию в течение 24 часов. Образцы фекалий следует хранить охлажденными (при +4 или на льду) и исследовать как можно быстрее после отбора, чтобы свести к минимуму риск гибели искомых микроорганизмов, излишнего размножения сопутствующих бактерий или выхода личинок гельминтов из яиц.
Двойная упаковка образцов фекалий в контейнеры с закручивающейся крышкой, затем помещенные в запечатанные пластиковые пакеты, поможет предотвратить кросс-контаминацию образцов и упаковочного материала. Фекалии, помещенные только в перчатки, пластиковые пакеты или пробирки с резиновыми крышками, непригодны, т.к. часто по причине бактериального роста образуется большое количество газа, который может разорвать пластик или выбить пробку, что приведет к вытеканию материала.
Отбор материала от живых животных. Эпителий и слизистые оболочки
Эпителиальные ткани в виде соскобов или биопсии, мазки со слизистой ротовой, носовой полостей, глотки и кишечного тракта, а также шерстинки могут быть использованы непосредственно для обнаружения поверхностных паразитов (вшей, блох), возбудителей грибковых, бактериальных и вирусных болезней. Для паразитологических исследований соскобы, шерсть можно направить в лабораторию между двумя предметными стеклами, упакованными в закрытый пакет или конверт. Для взятия материала со слизистых оболочек используют тампоны, материал которых должен быть нейтральным и не влиять на результаты исследования за счет присутствия ингибиторов. Хлопок не рекомендуется, лучше использовать дайкрон. Для исследований методом ПЦР тампон с материалом можно высушить на воздухе и поместить в пустую пробирку.
Образцы из конъюнктивы могут быть отобраны при оттягивании век и мягком проведении тампоном по поверхности. Образцы со слизистой носовой полости берут тампоном предпочтительно на проволочной ручке, так как деревянная не сгибается и может треснуть. Может быть полезно сначала увлажнить тампон физраствором. Тампон следует оставить на некоторое время в контакте с секретом (на одну минуту и более), затем поместить в пробирку и направить в лабораторию без промедления при температуре 4 градуса.
Отбор материала от живых животных. Половой тракт и сперма
Образцы могут быть взяты при промывании влагалища или препуция или с использованием соответствующих тампонов. Образцы с шейки матки или из уретры отбирают тампонами. Образцы спермы лучше всего получать с использованием искусственной вагины. Богатая спермиями фракция должна присутствовать в образце, при этом следует избегать контаминации антисептическим промывающим раствором.
Отбор материала от живых животных. Слюнная жидкость
Слюнная жидкость состоит из слюны и транссудата со слизистой (жидкости из кровеносных капилляров), поэтому она содержит как патогены (вирусы и бактерии), так и антитела. У свиней она может быть использована для обнаружения вирусов РРСС, гриппа свиней, цирковируса-2, а также некоторых бактерий (микоплазм). Жидкость может быть исследована методом ПЦР, что позволяет обнаружить даже небольшое количество возбудителей в образце, а также для обнаружения антител (особенно чувствительно для РРСС).
Преимущества:
- быстрый отбор материала (около 30 минут в зависимости от возраста свиней);
- незначительные затраты труда, не требуется специальная подготовка;
- не требуется большого количества расходного материала: 100% хлопковая веревка без обработки, стерильная пластиковая пробирка (50 мл), пластиковый пакет, ножницы.
Веревка должна размещаться в чистой зоне станка вдали от воды, корма и фекалий; ее подвешивают на высоту плеча на ограждение, ворота и т.д. После того, как свиньи жевали ее достаточное время, удаляют сухую часть веревки, помещают влажную часть в пластиковый пакет, выжимают веревку в пакете, отрезают угол пакета и переливают содержимое в пластиковую пробирку. Пробирку охлаждают или замораживают, направляют в лабораторию так быстро, как это возможно.
Преимущества метода
В результате получается один образец от целой группы животных, что повышает шанс выявления заболевания. Неинвазивная процедура: не используются иглы, шприцы, нет нужды отлавливать и удерживать животных, меньше стресса и риска, безопасно, процесс легко управляется. От персонала требуются минимальные навыки с затратой минимума времени. Меньше стоимость исследований из-за широкого охвата поголовья. Дешевые расходные материалы, много применений метода.
Недостатки метода
Маленьких поросят необходимо учить жевать веревку (первый раз дают веревку, смоченную сахарным раствором) Качество образца влияет на результат: возможно присутствие ингибиторов - грязи, фекалий, ферментов. Трудно выделять патогены в культуре или проводить секвенирование. Могут быть обнаружены патогены из внешней среды. Обнаружение агента не означает диагноз заболевания, для этого нужны ткань, кровь, другие более репрезентативные виды материала.
Посмертный отбор образцов
Образцы тканей из различных органов могут быть отобраны посмертно. Персонал должен быть обучен правильным процедурам вскрытия тех видов животных, с которыми они работают. Требуемое оборудование зависит от размера и вида животных, но необходимы нож, пила, пинцеты, скальпель и ножницы, включая ножницы с закруглёнными кончиками для вскрытия кишечника. Нужно иметь достаточно контейнеров и пробирок с транспортной средой, соответствующей природе отбираемых образцов, а также этикеток и бланков нужных форм. Контейнеры должны быть полностью подписаны с указанием даты, ткани или органа и идентификации животного. Для транспортировки полевого материала для культивирования требуются специальные транспортные среды.
При проведении вскрытия животных нужно соблюдать надлежащие меры биобезопасности в отношении персонала и для предотвращения контаминации отбираемых образцов, а также по защите окружающей среды и других животных от заражения патогенами. Как минимум, персонал должен иметь соответствующую одежду и средства индивидуальной защиты. Все оставшиеся органы и части туши должны быть упакованы и помещены в соответствующий дезинфектант или подвергнуты уничтожению, а объекты внешней среды должны быть тщательно продезинфецированы.
Ткани могут отбираться для культивирования микроорганизмов, паразитологии, биохимии, гистопатологии и иммуногистохимии, а также для детекции белков или геномных нуклеиновых кислот. Дополнительно могут быть отобраны мазки со слизистой щек, ротоглотки, прямой кишки, из полости суставов, из перикарда. Персонал, проводящий вскрытие, должен иметь соответствующую квалификацию и знания в анатомии и патологии, чтобы отобрать наиболее репрезентативный материал.
Из пораженных органов отбирают кусочки размером примерно 6х12 см, предпочтительнее на границе здоровой и пораженной ткани. Лимфоузлы отбирают целиком. Каждый кусочек ткани должен быть помещен в полностью маркированный отдельный пластиковый пакет или стерильную закрывающуюся крышкой банку. Соскобы на тампонах должны всегда помещаться в соответствующую транспортную среду. Необходимо использовать стерильный инструмент для отбора материала для бактериологического культивирования, и надо предпринимать меры для предотвращения контаминации тканей содержимым кишечника. Нельзя использовать дезинфектанты на самих тканях и рядом при направлении для бактериологического и вирусологического исследования.
Для свежих образцов особенно важно предупредить их порчу при хранении и транспортировке по причине бактериальной контаминации. В идеале, свежеотобранные образцы хранят при постоянной низкой температуре от момента отбора до начала исследования. Использование формалина для консервирования образца возможно только для некоторых видов исследований (гистологических, иммуногистохимических).
Если нет возможности доставить материал в лабораторию в срок менее 24 часов, образцы должны быть заморожены.
FTA карты
Для исследований методом ПЦР очень удобно использовать специально разработанные FTA карты. В них на основу из целлюлозы нанесены определенные ферменты, которые осуществляют лизис клеточных структур и способствуют высвобождению ДНК (РНК у вирусов). Фиксированная на волокнах после высыхания нанесенного материала нуклеиновая кислота может сохраняться длительное время при обычных температурах. Карты могут пересылаться любым способом в лабораторию, особых мер предосторожности, как биоматериал, они не требуют.
Для нанесения на карту пригодны жидкости, содержащие искомый инфекционный агент, например, кровь, выпоты, синовиальная жидкость и пр. Кровь можно нанести непосредственно из шприца после взятия. Любой другой материал, в том числе мазки со слизистых, отбирается тампоном, который сразу же прикладывается к окошку карты и прокатывается по нему для перенесения материала. Мазок-отпечаток паренхиматозного органа может быть сделан непосредственно на карту, при этом важно не контаминировать ее бумажную основу.
Перед направлением материала на картах в лабораторию следует уточнить, позволяют ли используемые в лаборатории методики выделения нуклеиновых кислот, обрабатывать такой вид материала.
Маркировка и информация
Подписывать образцы следует с учётом того, что они могут намокнуть или быть заморожены. Карандаш царапает контейнер, и этикетки могут отклеиться от пластика, если контейнер хранился при минус 20 и ниже. Сопроводительные документы должны быть помещены в пластиковый конверт вне транспортировочного контейнера, желательно продублировать информацию и внутри контейнера.
В сопроводительных документах указывают следующее:
- имя и адрес владельца, место, где отобран материал, имя и контакты направителя пробы;
- предполагаемое заболевание и необходимые исследования;
- вид, порода, пол, возраст и ID животных, от которых отобраны образцы;
- дата отбора образцов;
- опись направляемого материала;
- при необходимости и по требованию лаборатории: историю случая со следующими данными: продолжительность заболевания, дата первого случая и последующих, описание распространения болезни в стаде, количество животных на ферме, количество заболевших и павших, их возраст, пол и порода, клинические признаки и изменения, тип и стандарты содержания, особенно питания, контакт с ядовитыми растениями или ядами, ввод новых животных в стадо, лечение животных и когда давались препараты, вакцинация, другие наблюдения.
Упаковка и транспортировка образцов
Необходимо связаться с лабораторией, в которую направляется материал, для подтверждения того, что она имеет возможность провести требуемые тесты и уточнить, есть ли какие-нибудь специальные требования для упаковки или транспортировки материала.
Пересылка должна осуществляться в соответствии с правилами перевозки биологического материала, содержащего возбудителей болезней животных.
Образцы должны направляться в лабораторию самым быстрым доступным методом. Если образцы могут попасть в лабораторию в течение 24 часов, их следует доставлять охлаждёнными. Если используется сухой лёд, то могут потребоваться дополнительные условия упаковки.
Образцы должны попасть в лабораторию в хорошем состоянии, с сохраненной целостностью упаковки и без протечки в ходе транспортировки.
Упаковка должна состоять из трех компонентов: герметично закрытый первичный контейнер с материалом (пробирка, банка, пакет), непроницаемая вторичная упаковка (пластик, полимерная пленка), внешний контейнер необходимой вместительности и прочности, в котором по меньшей мере одна сторона измерения равна и более 10 см. Для жидкостей необходимо поместить в контейнер достаточное количество абсорбирующего материала между первичной емкостью и вторичной упаковкой, так, чтобы любые протечки жидкостей в ходе транспортировки не попадали на поверхность наружного контейнера. Если несколько хрупких емкостей с материалом помещаются в единственную вторичную упаковку, они должны быть индивидуально обернуты или другим способом разделены для предотвращения контакта друг с другом.
Для поддержания температурного режима в контейнер помещают предварительно замороженный хладоэлемент или сухой лед между вторичной оболочкой и внешними стенками. В случае использования сухого льда внешняя упаковка должна позволять выходить диоксиду углерода. Во внешний контейнер также помещают опись содержимого. Все направляемые вместе с материалом бумаги помещают в конверт (файл), который прикрепляют к внешней стороне транспортного контейнера.
Расчет количества отбираемых образцов
Тип и количество образцов, необходимое для исследования, зависит от предполагаемых целей.
Для подтверждения благополучия популяции по какой-либо инфекции количество образцов, которое должно быть отобрано в стаде определенного размера, для достижения 95% вероятности обнаружения инфекции или заражения, присутствующего у определенного процента животных
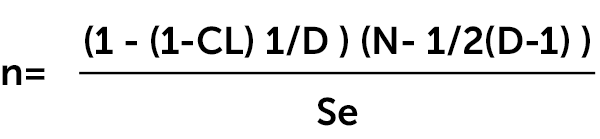
где
n – требуемое количество образцов
CL - доверительный интервал (обычно 0.95)
N - размер популяции животных
D - ожидаемое количество больных или зараженных животных
Se - диагностическая чувствительность метода исследования
Для популяции в 500 животных с распространенностью заболевания 10% при хорошей чувствительности метода исследования количество образцов будет равно
n= (1 - (1-0,95) 1/50) (500 - 1/2(50-1) )=28
При получении негативных результатов по всем образцам можно с достоверностью 95% утверждать, что распространение инфекции в стаде менее 10%. Если искомое заболевание высоко контагиозно и маловероятно, что только 10% животных заражены, то стадо может считаться благополучным. Если один или несколько образцов позитивны, то с достоверностью 95% можно сказать, что распространенность инфекции в стаде не менее 10%.
Подтверждение здоровья животных и безопасности получаемой от них продукции при продаже-перемещении
«Кодекс наземных животных» дает специальные рекомендации по торговле. Некоторые из них базируются на подтверждении благополучия по инфекции на уровне стада, тогда как другие предназначены для тестирования отдельных животных. Если благополучие по инфекции контролируется на уровне стада, то количество образцов рассчитывают по первой формуле. В случае обследования отдельных животных предполагается, что материал для исследования отбирают от каждого животного.
Оздоровление популяции от инфекции
Объективный надзор в случае вспышки – это попытка найти любые остаточные случаи инфекции. Отбор проб ориентирован на популяцию с высоким риском заражения и где агент с наибольшей вероятностью может быть обнаружен, например, среди животных с клиническими признаками или подозреваемыми в контакте с инфицированными животными. Если животные в отобранной группе не проявляют клинических признаков, следует отбирать материал по формуле 1.
Подтверждение диагноза
Подозрительные или клинические случаи с положительными результатами скринингового исследования должны быть повторно проверены референтным методом. Обычно тест с высокой диагностической чувствительностью используется для скрининговых целей, а тест с высокой специфичностью – для подтверждения результата. Если статус стада неизвестен, для взятия материала выбирают животных, проявляющих клинические признаки интересующего заболевания. Это увеличит вероятность подтверждения инфекции. При необходимости формула 1 может быть использована для подсчета количества образцов. При условии, что материал отбирается от животных с клиническими признаками, предполагаемая распространенность инфекции может быть установлена относительно высокой, что приведет к уменьшению количества образцов.